Co to jest walidacja czyszczenia?
Czym jest walidacja procesu w przypadku żywności i napojów?
Walidacja procesu to sposób na wykazanie, że od produkcji po dystrybucję stosowane są odpowiednie metody przetwarzania żywności, proces ten wymaga zebrania dokumentacji i danych, czy to z literatury naukowej, badań wewnętrznych, czy też zasobów regulacyjnych.
Na czym polega walidacja procesu w przypadku żywności i napojów?
Na gromadzeniu i ocenie informacji naukowych oraz technicznych w celu ustalenia, czy proces (obróbka), stosowany w odpowiedni sposób, skutecznie kontroluje zagrożenie mikrobiologiczne, lub innymi słowy, czy kryteria procesu mogą w wiarygodny sposób zapewnić osiągnięcie określonego celu wydajnościowego. Ogólną skuteczność środków kontroli należy walidować zgodnie z częstością występowania zagrożeń mikrobiologicznych w danej żywności, biorąc pod uwagę charakterystykę poszczególnych zagrożeń, ustalone cele w zakresie bezpieczeństwa żywności/wyników oraz poziom ryzyka dla konsumenta.
W jakich branżach walidacja czyszczenia jest obowiązkowa
Walidacja jest wymagana tam, gdzie ryzyko skażeń zagraża zdrowiu konsumentów lub jakości produktu. Obowiązuje w produkcji farmaceutyków, żywności, wyrobów medycznych, kosmetyków oraz w branżach biotechnologicznych. Wymogi wynikają z GMP, HACCP, ISO 22000 i innych regulacji jakościowych.
Walidacja czystości jest obowiązkowa przede wszystkim w branżach, gdzie najwyższe standardy jakości i bezpieczeństwa są niezbędne ze względu na ryzyko skażenia produktów i zagrożenia dla zdrowia. Do tych branż należą:
- Branża farmaceutyczna – walidacja cleanroom, czyli pomieszczeń czystych, jest niezbędna, aby zapewnić, że środowisko produkcyjne spełnia rygorystyczne normy GMP i chroni przed kontaminacją leków i substancji aktywnych.
- Produkcja żywności – szczególnie tam, gdzie wymagana jest zgodność z normami HACCP i ISO 22000 dotycząca higieny i kontroli mikrobiologicznej podczas całego procesu produkcji.
- Przemysł kosmetyczny – gdzie czystość środowiska i urządzeń ma istotny wpływ na jakość i bezpieczeństwo produktów.
- Produkcja wyrobów medycznych i biotechnologia – w tym wytwarzanie wyrobów implantacyjnych oraz sterylnych materiałów medycznych.
- Elektronika i przemysł motoryzacyjny – w strefach wymagających środowisk o kontrolowanej czystości powietrza zgodnie z normami cleanroom, ponieważ pył i mikrocząstki mogą zaburzać procesy technologiczne.
- Opieka zdrowotna – walidacja pomieszczeń czystych w szpitalach, blokach operacyjnych i aptekach.
Procesy walidacji pomieszczeń czystych (cleanroom) i procedur higienicznych realizowane są zgodnie z normami ISO 14644 i GMP, które określają klasy czystości powietrza oraz metody pomiarowe. Dokumentacja i raportowanie walidacji są elementem zapewniającym zgodność z regulacjami i są konieczne do przeprowadzenia audytów jakościowych
Czym różni się walidacja od weryfikacji procesu mycia
Etapy walidacji i weryfikacji procesu
Po opracowaniu procedur produkcyjnych i parametrów przetwarzania należy wykonać dwa kroki, aby zapewnić zgodność z akceptowalnymi standardami: walidację i weryfikację.
Walidacja procesu to przedsięwzięcie polegające na generowaniu danych potwierdzających skuteczność procesu w osiąganiu zamierzonego efektu.
Weryfikacja procesu to przedsięwzięcie polegające na ciągłym monitorowaniu krytycznych parametrów w celu potwierdzenia, że zostały one wdrożone zgodnie z projektem i walidowane poprzez walidację procesu.
Podsumowując, walidacja odpowiada na pytanie „Czy proces mycia może skutecznie działać?”, a weryfikacja – „Czy proces mycia jest wykonywany prawidłowo?”. Obie fazy są niezbędne do zapewnienia stałej jakości i bezpieczeństwa produkcji, ale to walidacja dostarcza formalnego dowodu skuteczności, natomiast weryfikacja zapewnia kontrolę codziennej realizacji procesu.
Zbyt częstym błędem audytowym jest traktowanie pozytywnego wyniku weryfikacji jako dowodu skuteczności procesu, podczas gdy właściwy wynik walidacji musi potwierdzić skuteczność procesu mycia na poziomie mikrobiologicznym i chemicznym.
Także weryfikacja powinna odbywać się regularnie, zgodnie z oceną ryzyka i przyjętym harmonogramem kontroli w zakładzie.
Ten podział funkcji walidacji i weryfikacji jest powszechnie zaakceptowany i wymagany w normach BRC, IFS, GMP oraz HACCP.
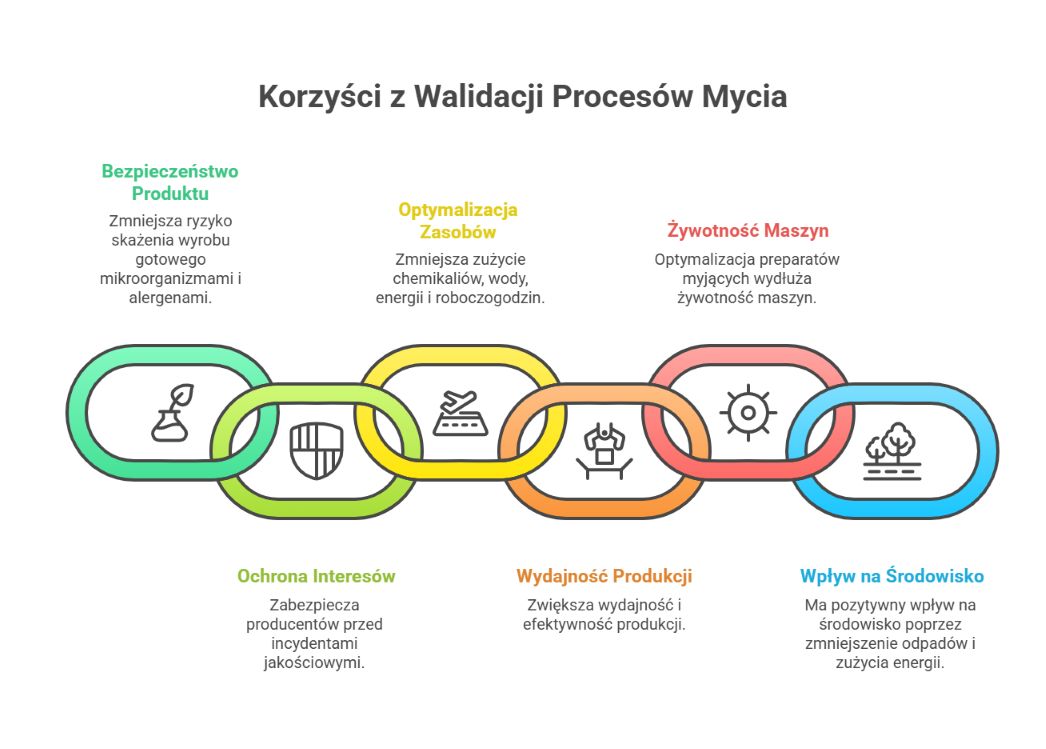
Dlaczego walidacja czyszczenia jest nieodzowna?
Gwarancja bezpieczeństwa i najwyższej jakości produktów
Walidacja czyszczenia to podstawowy filar zapewniający, że wszystkie procedury mycia skutecznie eliminują pozostałości zanieczyszczeń mikrobiologicznych, chemicznych oraz fizycznych. Tylko dzięki dokładnemu, systematycznemu potwierdzeniu skuteczności procesu można mieć pewność, że produkt końcowy spełnia wymagania bezpieczeństwa oraz oczekiwania jakościowe, co jest niezwykle istotne zwłaszcza w sektorze spożywczym skierowanym do najbardziej wrażliwych grup konsumentów. Walidacja w tym kontekście to nie tylko usunięcie widocznych zabrudzeń, ale także skuteczna redukcja patogenów, alergenów i pozostałości chemicznych do poziomu bezpiecznego dla zdrowia.
Dodatkowo walidacja procesu mycia pozwala na optymalizację zużycia środków myjących oraz czasu czyszczenia, co przekłada się na efektywność kosztową i ekologiczność całego procesu w zakładzie produkcyjnym. Współpraca między działami jakości, technologii i utrzymania ruchu jest tu kluczowa, aby zapewnić ciągłość procesu oraz jego zgodność z przepisami i wymaganiami audytów.
Warto też pamiętać, że walidacja czyszczenia jest szczególnie istotna w produkcji żywności dla grup o wyższym ryzyku zdrowotnym, takich jak dzieci, osoby starsze czy alergicy, gdzie nawet najmniejsze zanieczyszczenie może mieć poważne skutki.
Dzięki właściwie przeprowadzonej walidacji zakład zyskuje nie tylko pewność produkcji bezpiecznej żywności, ale także przewagę konkurencyjną, realizując wymogi rynku i przepisów na najwyższym poziomie.
Spełnianie norm oraz wymogów audytowych
Przeprowadzenie walidacji to obowiązek wynikający z systemów zarządzania bezpieczeństwem żywności, takich jak HACCP i GMP. Stanowi też kluczowy element podczas audytów przeprowadzanych przez jednostki certyfikujące oraz regulatorów. Dokumentacja skuteczności procesu czyszczenia potwierdza zgodność z obowiązującymi standardami, będąc jednocześnie gwarancją transparentności i odpowiedzialności produkcyjnej.
Minimalizacja ryzyka skażeń oraz redukcja strat produkcyjnych
Skuteczne wdrożenie i utrzymanie walidowanego procesu zmniejsza możliwość krzyżowego skażenia produktów, co zapobiega wprowadzaniu na rynek wyrobów niebezpiecznych lub niespełniających norm. Ponadto pozwala to ograniczyć straty finansowe związane z wycofaniem wadliwych serii czy przerwami produkcyjnymi. Walidacja umożliwia również optymalizację działań związanych z myciem i dezynfekcją, eliminując niepotrzebne koszty przy jednoczesnym zachowaniu wysokiej efektywności.
Etapy walidacji procesu czyszczenia krok po kroku
1. Analiza procesu i identyfikacja krytycznych punktów
Faza inicjująca polega na przeprowadzeniu szczegółowej analizy ryzyka (ang. Risk Assessment) dla całego środowiska produkcyjnego. Celem jest identyfikacja powierzchni najbardziej narażonych na retencję zanieczyszczeń, ze szczególnym uwzględnieniem punktów geometrycznie trudnych (np. uszczelnienia, spawy, zagięcia rurociągów, dysze CIP) oraz obszarów o podwyższonym ryzyku biofilmowania. W tym etapie określa się również najtrudniejsze do usunięcia zanieczyszczenia (ang. worst-case residue), uwzględniając specyfikę mikrobiologiczną, chemiczną i obecność alergenów. Wynikiem jest precyzyjny plan poboru prób i określenie zakresu walidacji.
2. Dobór metod i parametrów walidacyjnych
Na tym etapie ustala się parametry procesu czyszczenia (czas, temperatura, stężenie detergentów, szybkość przepływu) oraz wybiera adekwatne metody badawcze (mikrobiologiczne, chemiczne, testy ATP itp.), które posłużą do oceny skuteczności mycia. Wszystkie kryteria muszą opierać się na naukowo uzasadnionych limitach akceptacji (ang. Acceptance Criteria), które gwarantują osiągnięcie zdefiniowanego poziomu bezpieczeństwa.
3. Pobieranie próbek i badania skuteczności mycia
Praktyczna walidacja polega na przeprowadzeniu co najmniej trzech kolejnych, niezależnych cykli czyszczenia. Pobór próbek musi być realizowany z wcześniej zidentyfikowanych punktów krytycznych, natychmiast po zakończeniu procedury sanitarnej. W trakcie testów stosuje się zasadę najgorszego przypadku (worst-case scenario), symulując najbardziej wymagające warunki operacyjne (np. maksymalny czas zabrudzenia Dirty Hold Time lub najbardziej oporny produkt). Wykonane analizy laboratoryjne muszą obiektywnie potwierdzić, że poziom pozostałości znajduje się poniżej ustalonych limitów.
Wybierając punkty do walidacji procesu mycia, powinno się kierować zasadą wskazującą na miejsca o najwyższym ryzyku niedokładnego oczyszczenia. Oznacza to, że testy powinny być przeprowadzane tam, gdzie najtrudniej jest utrzymać higienę.
Takie krytyczne miejsca to:
- Urządzenia charakteryzujące się konstrukcją utrudniającą skuteczne mycie — np. powierzchnie o chropowatej fakturze, spawy niskiej jakości, szczeliny, ostre krawędzie, martwe kąty oraz rozgałęzienia rur i instalacji.
- Elementy, na których gromadzi się woda, takie jak zbiorniki, pompy czy zawory, ponieważ stojąca woda może sprzyjać rozwojowi mikroorganizmów.
- Wymienniki ciepła (pasteryzatory, wyparki, komory parzelnicze i wędzarnicze), szczególnie te wykorzystywane do obróbki cieplnej produktów zawierających białko, które są podatne na tworzenie trudnych do usunięcia osadów.
- Urządzenia oraz linie produkcyjne, które pozostają bez mycia przez długi czas po zakończeniu produkcji — zaleca się, aby mycie rozpoczynać jak najszybciej po jej zakończeniu.
- Urządzenia i linie produkcyjne, gdzie przerwy między kolejnymi pełnymi cyklami mycia i dezynfekcji są długie, często z powodu wydłużonego czasu produkcji, na przykład podczas sezonowych kampanii zbioru owoców i warzyw.
Takie podejście pozwala skoncentrować badania walidacyjne na obszarach o największym ryzyku, co zwiększa pewność skuteczności procesu mycia i zapewnia wysokie standardy higieniczne w zakładzie.
4. Ocena wyników i opracowanie raportu walidacyjnego
Zebrane dane analityczne podlegają szczegółowej interpretacji statystycznej i porównawczej względem zatwierdzonych kryteriów akceptacji. Końcowy Raport Walidacyjny stanowi formalne podsumowanie procesu, zawierając metodologię badań, pełne wyniki, analizę odchyleń oraz konkluzję dotyczącą zgodności. Pozytywny wynik raportu upoważnia do formalnego zatwierdzenia (autoryzacji) procedury mycia i dezynfekcji do rutynowego stosowania.
5. Wdrażanie działań korygujących i ponowna walidacja
Jeśli wyniki walidacji wskazują na niespełnienie założeń, konieczne jest przeprowadzenie analizy przyczyn i wprowadzenie działań korygujących. Obejmuje to analizę przyczyn źródłowych i natychmiastowe wdrożenie działań korygujących (np. modyfikacja parametrów krytycznych, zmiana technologii lub chemii). Po implementacji korekt, konieczne jest przeprowadzenie ponownej walidacji (Re-walidacji), aby niezależnie i obiektywnie udowodnić, że zmodyfikowany proces przywrócił pełną skuteczność i gwarantuje stabilny poziom higieny. Negatywny wyniki walidacji mogą zmusić do myślenia, co poszło nie tak i konieczne będzie sprawdzenie poprawności takich elementów jak:
- przebiegu procesu produkcyjnego,
- realizacji czynności mycia i dezynfekcji,
- sposobu pobierania próbek testowych,
- wykonania oraz interpretacji testów kontrolnych.
Reasumując działania korygujące mogą obejmować różne obszary procesu, w zależności od przyczyny wystąpienia niezgodności. Najczęściej dotyczą one:
- procesu mycia i dezynfekcji – np. podniesienia temperatury środka myjącego, wydłużenia czasu kontaktu, zwiększenia stężenia lub zastosowania innego środka myjącego i/lub dezynfekcyjnego,
- procesu produkcyjnego – np. skrócenia czasu pomiędzy zakończeniem produkcji a rozpoczęciem mycia, ograniczenia długości serii produkcyjnej czy częstszego przeprowadzania pełnych cykli czyszczenia,
- maszyn, urządzeń i linii produkcyjnej – np. eliminacji miejsc sprzyjających zastoinom wody, wymiany elementów o zbyt dużej chropowatości, kontroli stanu uszczelek lub wygładzenia spawów w newralgicznych punktach konstrukcji.

Jakie metody stosuje się w walidacji procesów czyszczenia?
Walidacja procesów czyszczenia i dezynfekcji opiera się na zastosowaniu zestawu różnorodnych metod, które pozwalają na wszechstronną ocenę efektywności tych działań. Poniżej przedstawiam najważniejsze techniki, które są pilnie stosowane w profesjonalnych protokołach walidacyjnych
Testy ATP i pomiary resztkowe
Testy z wykorzystaniem adenozynotrójfosforanu (ATP) to szybka, ilościowa metoda oceny czystości powierzchni. ATP jest cząsteczką występującą we wszystkich żywych komórkach, w tym w bakteriach, drożdżach, pleśniach oraz resztkach organicznych. Pomiary za pomocą luminometru pozwalają na błyskawiczne określenie całkowitego poziomu pozostałości organicznych, co umożliwia natychmiastowe podjęcie decyzji o wznowieniu produkcji lub potrzebie ponownego czyszczenia. Testy ATP są doskonałym narzędziem do rutynowego monitorowania higieny, uzupełniając bardziej czasochłonne metody laboratoryjne.
Analiza mikrobiologiczna: potwierdzenie skuteczności dezynfekcji
Analiza mikrobiologiczna jest złotym standardem w walidacji, ponieważ dostarcza bezpośredniego dowodu na eliminację mikroorganizmów. Procedura ta polega na pobraniu wymazów lub użyciu płytek odciskowych z kluczowych punktów krytycznych, a następnie na laboratoryjnym badaniu w celu zliczenia:
- Ogólnej liczby drobnoustrojów (liczby kolonii).
- Obecności patogenów docelowych, takich jak Listeria czy Salmonella.
Wyniki tych badań weryfikują skuteczność dezynfekcji i są kluczowe dla zapewnienia, że środowisko produkcji jest wolne od niebezpiecznych drobnoustrojów.
Analizy chemiczne: Kontrola resztek i alergenów
Badania chemiczne są niezbędne do wykrycia niewidocznych, ale potencjalnie szkodliwych zanieczyszczeń. Wykorzystują zaawansowane techniki laboratoryjne, takie jak chromatografia cieczowa czy spektrometria, aby precyzyjnie identyfikować i kwantyfikować:
- Pozostałości środków myjących i dezynfekujących, które mogłyby negatywnie wpłynąć na produkt.
- Śladowe ilości alergenów, co jest kluczowe w walidacji czyszczenia między partiami produktów o różnych składach alergennych.
Precyzyjne wyniki tych analiz są fundamentem weryfikacji procedur sanitarnych.
Wizualna inspekcja i techniki pobierania próbek
Walidacja czyszczenia zawsze zaczyna się od wizualnej inspekcji, ponieważ nawet drobne, widoczne zanieczyszczenia mogą świadczyć o nieskutecznym procesie. Profesjonaliści używają do tego celu specjalistycznego oświetlenia, a często i endoskopów do kontroli trudno dostępnych obszarów. Oprócz wizualnego potwierdzenia, kluczowe jest precyzyjne pobieranie próbek. Używa się do tego wymazów (ang. swabs) lub próbek popłuczyn (ang. rinse samples), które umożliwiają pobranie i analizę zanieczyszczeń z określonych powierzchni i z wnętrza rurociągów czy zbiorników. Dokumentacja fotograficzna stanowi zaś niezbity dowód wizualny, uzupełniający i wspierający wyniki badań laboratoryjnych.
Jak często należy przeprowadzać walidację?
Regularna walidacja jest niezbędna, aby zapewnić ciągłą skuteczność procesów mycia i dezynfekcji. Częstotliwość walidacji powinna uwzględniać stabilność procesu technologicznego, jeśli nie wprowadzono zmian, typowo przeprowadza się ją okresowo, np. raz na rok lub zgodnie z wymaganiami branżowymi i normami. W przypadku istotnych zmian w procesie technologicznym częstotliwość walidacji powinna wzrosnąć, aby zweryfikować, czy proces nadal spełnia wymagania jakościowe i higieniczne.
Kiedy w praktyce przeprowadza się walidację?
- Po zainstalowaniu nowych maszyn, urządzeń lub linii produkcyjnych.
- W przypadku wprowadzenia zmian:
- w parametrach procesu mycia i dezynfekcji (np. zmiana dostawcy środków czyszczących, zastosowanego środka myjącego lub dezynfekcyjnego, stężenia, temperatury czy czasu kontaktu),
- w parametrach procesu technologicznego (np. zmiana temperatury pasteryzacji, sterylizacji, parzenia),
- w stosowanych surowcach, właściwościach półproduktów lub wyrobów gotowych (np. zmiana lepkości, zawartości białek, dodanie alergenów, zmiana lub dodanie barwnika czy aromatu),
- w lokalizacji urządzeń produkcyjnych (zmiana konfiguracji linii produkcyjnej),
- w systemie sterowania.
Okresowa walidacja a zmiany w procesie technologicznym
Po każdej modernizacji linii produkcyjnej lub zmianie stosowanych preparatów myjących wymagana jest walidacja, która potwierdzi skuteczność nowego procesu lub środków. Zmiany te mogą wpływać na parametry mycia, takie jak czas kontaktu, stężenie preparatu czy temperatura, dlatego potwierdzenie ich efektywności jest kluczowe dla utrzymania bezpieczeństwa i jakości produktu.
⚠️ Ważne!
Nie każda zmiana w procesie produkcji automatycznie oznacza konieczność ponownej walidacji procesu mycia i dezynfekcji.
Jeśli modyfikacja nie wpływa na skuteczność czyszczenia i mieści się w zakresie wcześniej zatwierdzonej walidacji,
nie ma potrzeby jej powtarzania!Ponowna walidacja jest natomiast wymagana, gdy wprowadzony produkt, urządzenie lub zmiana technologiczna mogą powodować trudniejsze warunki czyszczenia niż te, które zostały wcześniej potwierdzone.
W takiej sytuacji walidacja może dotyczyć tylko nowego elementu linii, szczególnie jeśli jest on ostatnim etapem procesu produkcyjnego.
Wpływ audytów i certyfikacji na częstotliwość walidacji
Audytorzy oraz jednostki certyfikujące w ramach systemów takich jak HACCP, ISO 22000, BRCGS czy GMP, odgrywają kluczową rolę w utrzymaniu wysokich standardów higieny i bezpieczeństwa produkcji. W swoich wymaganiach często precyzują częstotliwość przeprowadzania walidacji procesów mycia i dezynfekcji, określając minimalne interwały czasowe lub wskazując konieczność ich ponowienia po każdej znaczącej zmianie technologicznej, produktowej bądź organizacyjnej.
Regularne audyty zewnętrzne i wewnętrzne pozwalają na bieżąco oceniać skuteczność istniejących procesów czyszczenia. Weryfikują nie tylko kompletność dokumentacji walidacyjnej, ale również to, czy stosowane parametry procesów takie jak temperatura, czas kontaktu, stężenie środków czy sposób aplikacji, pozostają skuteczne i zgodne z pierwotnie zweryfikowanymi warunkami. Audytorzy mogą także wskazywać potrzebę rewalidacji po wdrożeniu nowych urządzeń, zmianie środków chemicznych lub modyfikacji linii produkcyjnej.
W praktyce przedsiębiorstwa coraz częściej traktują walidację nie tylko jako obowiązek certyfikacyjny, ale jako integralny element zarządzania ryzykiem w systemie jakości. Regularne potwierdzanie skuteczności mycia i dezynfekcji stanowi jeden z filarów ciągłego doskonalenia procesu i pozwala wykazać faktyczną kontrolę nad czystością mikrobiologiczną oraz bezpieczeństwem produktu.
Częstotliwość walidacji procesów mycia i dezynfekcji powinna wynikać nie tylko z wymagań audytorów czy standardów certyfikacyjnych, ale przede wszystkim z analizy ryzyka i skuteczności samego procesu.
Rzetelna walidacja, przeprowadzana w regularnych odstępach oraz po istotnych zmianach, jest podstawowym narzędziem zapewnienia bezpieczeństwa żywności, minimalizacji zagrożeń higienicznych i budowania zaufania odbiorców do jakości produktów.








